แบบจำลองอะตอม
แนวคิดในการพัฒนาแบบจำลองอะตอม
ในสมัยโบราณมีนักปราชญ์ชาวกรีกชื่อ ดิโคริตุส (Democritus) เชื่อว่าเมื่อย่อยสารลงเรื่ออย ๆ
จะได้ส่วนที่เล็กที่สุดซึ่งไม่สามารถทำให้เล็กลงกว่าเดิมได้อีก
และเรียกอนุภาคขนาดเล็กที่สุดว่า อะตอม ซึ่งคำว่า "อะตอม"(atom) เป็นคำซึ่งมาจากภาษากรีกว่า (atomas) แปลว่า แบ่งแยกอีกไม่ได้
สสารทั้งหลายประกอบด้วยอนุภาคที่เล็กที่สุด
จะไม่สามารถมองเห็นได้และจะไม่สามารถแบ่งแยกให้เล็กลงกว่านั้นได้อีก
แต่ในสมัยนั้นก็ยังไม่มีการทดลอง เพื่อพิสูจน์และสนับสนุนแนวความคิดดังกล่าว
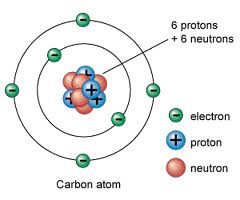
แบบจำลองอะตอม (Atomic model) เป็นภาพทางความคิดที่แสดงให้เห็น
รายละเอียดของโครงสร้างอะตอมที่สอดคล้อง กับผลการทดลองและใช้อธิบายปรากฏการณ์
ของอะตอมได้อ่านเพิ่มเติม